global point of care
Eine unabhängige Studie bestätigt, dass das Afinion™ 2 am Point-of-Care
HbA1c-Ergebnisse in Laborqualität liefert
Laborgenaue HbA1c-Tests am Point-of-Care
Genaue HbA1c-Messungen sind für die Diagnose und Behandlung von Diabetes von hoher Relevanz. Obwohl viele Geräte für den Einsatz am Point-of-Care (POC) von der International Federation of Clinical Chemistry (IFCC) und dem National Glycohemoglobin Standardization Program (NGSP) zertifiziert sind, spiegelt die Zertifizierung allein möglicherweise nicht die reale Leistung wider.
In einer kürzlich durchgeführten unabhängigen Studie zur Beurteilung von 19 HbA1c-Analysegeräten für den POC ergaben sich erhebliche Unterschiede bei der Analysequalität. Das Afinion™ 2 Analysegerät erwies sich als Top-Performer und erfüllte oder übertraf alle wichtigen Leistungskriterien.
Überblick über die unabhängige Studie: Vergleich von 19 HbA1c-Analysegeräten für den POC
In dieser Studie von Lenters-Westra et al. wurde eine Beurteilung der Leistung von 19 POC-Geräten, unter anderem nach den Zertifizierungskriterien der IFCC (International Federation of Clinical Chemistry and Laboratory Medicine) und des NGSP (National Glycohemoglobin Standardization Program), durchgeführt.1 Die IFCC und das NGSP zertifizieren HbA1c-Assays zur Gewährleistung genauer, standardisierter Testergebnisse für die zuverlässige Diagnose und das Management von Diabetes. Die POC-Geräte wurden mit vier Laborreferenzmethoden verglichen, die im European Reference Laboratory for Glycohemoglobin (ERL) (Europäisches Referenzlabor für Glykohämoglobin) zur Herstellerzertifizierung verwendet werden.
Die Studienautoren hatten bereits zuvor mehrere Leistungsbeurteilungen von POC-Geräten anhand von etablierten Qualitätskriterien durchgeführt, und das Afinion System hat durchgängig gute Ergebnisse erzielt.2,3
Die Studie wurde in zwei Phasen durchgeführt, in denen jeweils 10 Geräte überprüft wurden. Das Afinion 2 wurde in beiden Phasen untersucht und diente als Benchmark zur Gewährleistung der Einheitlichkeit in der Studie. Es wurden HbA1c-Konzentrationen im gesamten diagnostischen Bereich getestet, d. h. im normalen (gesunden), prädiabetischen und diabetischen Bereich.
Wichtigste Ergebnisse: Das Afinion 2 ist im Hinblick auf die HbA1c-Testgenauigkeit führend
- Das Afinion 2 Analysegerät erreichte VKs ≤ 2,0 % in NGSP-Einheiten und VKs ≤ 3,0 % in IFCC-Einheiten. Das Afinion 2 Analysegerät erreichte VKs ≤ 2,0 % in NGSP-Einheiten und VKs ≤ 3,0 % in IFCC-Einheiten bei allen getesteten Konzentrationsstufen. Lediglich zwei weitere Geräte erfüllten diese Kriterien in Bezug auf NGSP-Einheiten und ein anderes Gerät erfüllte die Kriterien in Bezug auf IFCC-Einheiten.
- Das Afinion 2 erfüllte die IFCC- und die NGSP-Zertifizierungskriterien. Die jährliche Zertifizierung ist möglicherweise kein ausreichender Indikator für die Qualität, da viele der POC-Geräte IFCC- und/oder NGSP-zertifiziert waren, aber nur fünf Geräte erfüllten beide Leistungskriterien in dieser Studie.

- Das Afinion 2 war das einzige Gerät, das die IFCC-Kriterien für die Eignung zur Anwendung in klinischen Studien erfüllte. Zehn POC-Geräte erfüllten den IFCC-Mindeststandard für die routinemäßige klinische Anwendung (> 2σ), wohingegen das Afinion 2 als einziges Gerät die strengeren IFCC-Kriterien für die Eignung zur Anwendung in klinischen Studien (> 4σ) erfüllte.
- Die analytische Leistung ist von hoher Relevanz für die klinische Versorgung. Einige der Geräte wiesen signifikante negative Messabweichungen auf, die zu Fehldiagnosen oder falschen Behandlungsentscheidungen führen könnten.
Die Ergebnisse im Detail: Leistungsmetriken für die HbA1c-Analysegeräte
Präzision
- Afinion 2, Atellica DCA und On Call MultiPro waren die einzigen drei der 19 untersuchten POC-Geräte, die bei allen in NGSP-Einheiten berechneten getesteten Konzentrationsstufen (4,9 %, 6,5 % und 9,0 % HbA1c) VKs ≤ 2,0 % erzielten.
- Nur Afinion 2 und Atellica DCA erreichten bei allen drei in IFCC/SI-Einheiten berechneten getesteten Konzentrationsstufen (30, 48 und 75 mmol/mol) VKs ≤ 3 %.
Richtigkeit (Messabweichung)
- Die Messabweichung wurde bei drei Konzentrationsstufen berechnet: 5,0 %, 6,5 % und 9,0 % HbA1c (30, 48 und 75 mmol/mol).
- Das Afinion 2 zeigte eine geringe Messabweichung gegenüber dem Mittelwert der vier Referenzmethoden im Bereich von -0,12 bis -0,06 % HbA1c (-1,3 bis -0,7 mmol/mol).
IFCC-Kriterien
- Die IFCC-Zertifizierungskriterien erfordern, dass der berechnete Sigma-Wert für Routinemethoden > 2σ und für die Verwendung in klinischen Studien > 4σ beträgt. Der Sigma-Wert wird anhand der Messabweichung, des VK und eines auf 6,9 % (10 % in SI-Einheiten) festgelegten zulässigen Gesamtfehlers (Total Allowable Error, TAE) mit der folgenden Formel berechnet: Sigma = (TAE – Messabweichung) / VK.
- Das Afinion 2 war das einzige POC-Gerät, das das strengere Kriterium von > 4σ erfüllte. 10 Geräte erfüllten die Kriterien für die routinemäßige klinische Anwendung (> 2σ).
NGSP-Kriterien
- Die NGSP-Zertifizierungskriterien erfordern, dass 36 von 40 Ergebnissen innerhalb von ± 5 % einer Laborreferenzmethode liegen
- Afinion 2 und Quo-Lab waren die einzigen zwei POC-Geräte, die die NGSP-Kriterien bei allen vier Laborreferenzmethoden in Phase 1 erfüllten. In Phase 2 erfüllte das Afinion 2 die Kriterien bei allen Referenzmethoden mit nur einer Ausnahme (Tosoh G11).
- Nur fünf (Afinion 2, cobas b 101, Quo-Lab, Atellica DCA, On Call MultiPro) der 19 POC-Geräte erfüllten die NGSP-Kriterien bei mindestens einer der Laborreferenzmethoden.
Proben mit hoher HbA1c-Konzentration
- In der Studie wurden Proben im Bereich von 11,6 % (103 mmol/mol) bis 15,7 % HbA1c (148 mmol/mol) getestet. Diese Analysen sind von hoher Relevanz, da in externen Programmen zur Qualitätsbewertung (EQA), wie sie vom College of American Pathologists (CAP) durchgeführt werden, normalerweise keine Proben mit hohen HbA1c-Konzentrationen untersucht werden.4
- Das Afinion 2 zeigte bei Proben mit hohen HbA1c-Konzentrationen im Vergleich zur Laborreferenzmethode (Tosoh G8) geringe Unterschiede im Bereich von -2,1 % bis 2,3 %.
Hämoglobinvarianten
- Das Afinion 2 konnte nicht auf Hämoglobinvarianten-Interferenz beurteilt werden, da in der Studie gefrorene Proben verwendet wurden, für die das Afinion 2 nicht ausgelegt ist.
- Es ist jedoch zu beachten, dass bereits zuvor gezeigt wurde, dass das Afinion 2 keine signifikanten Interferenzen durch Hämoglobinvarianten aufweist, ausgenommen bei hohen HbF-Konzentrationen (> 10 %). Das Testprinzip des Afinion 2 (Boronat-Affinität) ist gegenüber Hämoglobinvarianten unempfindlich.5
Zusammenfassung der wichtigsten Leistungskriterien
In der folgenden Tabelle ist die Leistung aller 19 POC-Geräte im Vergleich zu den in der Studie beurteilten Kriterien zusammengefasst.
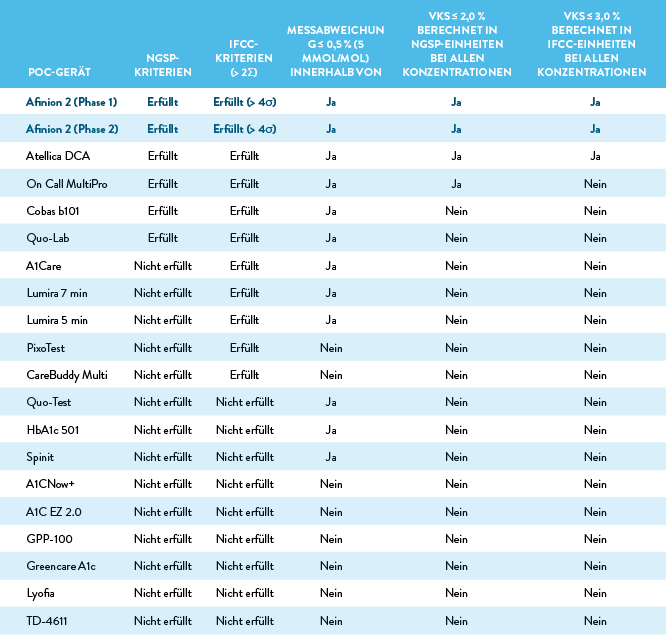


Gemäß NGSP-Zertifizierungskriterien müssen die Ergebnisse für mindestens 36 von 40 Proben innerhalb von ± 5 % der Ergebnisse von mindestens einer Laborreferenzmethode liegen. Die IFCC-Kriterien sind > 2σ für Routinemethoden und > 4σ für die Verwendung in klinischen Studien bei Berechnung anhand der folgenden Formel: Sigma = (TAE – Messabweichung)/VK, wobei der TAE-Wert (Gesamtanalysefehler) auf 6,9 % (10 % in SI-Einheiten) festgelegt ist und die Messabweichung gemäß CLSI EP-9-A3 und der VK gemäß CLSI EP-15-A3 bei jeweils 6,5 % HbA1c (48 mmol/mol) gemessen werden. Die Messabweichung wurde bei 3 Konzentrationsstufen (5,0 %, 6,5 % und 9,0 % HbA1c bzw. 30, 48, und 75 mmol/mol) beurteilt. Auf Abweichungen von > 0,5 % (5 mmol/mol) innerhalb des 95 %-KI wurden von den Studienautoren hingewiesen. Die Präzision wurde anhand von 3 Konzentrationsstufen (4,9 %, 6,5 % und 9,0 % HbA1c bzw. 30, 48, und 75 mmol/mol) untersucht; auf VKs > 2,0 % (> 3,0 %) wurde von den Studienautoren hingewiesen.
Zertifizierungsüberschreitende Qualitätsbeurteilung
Obwohl viele der in dieser Beurteilung untersuchten POC-Geräte NGSP- und IFCC-zertifiziert sind, war die Leistung der meisten dieser Geräte unzureichend, was den Schluss zulässt, dass eine einzelne jährliche Zertifizierung möglicherweise kein ausreichender Qualitätsindikator ist.
Diese unabhängige Beurteilung unterstreicht die Leistungsunterschiede zwischen NGSP- und IFCC-zertifizierten HbA1c-Geräten für den POC. Die Zertifizierung ist zwar wichtig, garantiert jedoch keine einheitliche Analysequalität.
Das Afinion 2 Analysegerät stach als einziges Gerät hervor, das alle Leistungskriterien erfüllte, einschließlich der strengen IFCC-Schwelle von > 4σ für klinische Studien. Diese Ergebnisse unterstreichen die Bedeutung der individuellen Gerätevalidierung und unterstützen den Einsatz von Afinion 2 sowohl in der Routineanwendung als auch für erweiterte klinische Zwecke.
Die vollständigen Daten sowie ausführliche Angaben zur Methodik und der statistischen Analyse hinter diesen Ergebnissen sind der vollständigen veröffentlichten Studie von Lenters-Westra et al. zu entnehmen.
Literaturhinweise
- Lenters-Westra E, Singh P, Vetter B, English E. Challenges in Hb A1c Point-of-Care Testing: Only 5 of 19 Hb A1c Point-of-Care Devices Meet IFCC and NGSP Certification Criteria on Independent Evaluation. Clin Chem. Published online May 26, 2025. doi:10.1093/clinchem/hvaf059
- Lenters-Westra E, Slingerland RJ. Three of 7 hemoglobin A1c point-of-care instruments do not meet generally accepted analytical performance criteria. Clin Chem. 2014;60(8):1062–1072. doi:10.1373/clinchem.2014.224311
- Lenters-Westra E, English E. Evaluation of four HbA1c point-of-care devices using international quality targets: are they fit for the purpose? J Diabetes Sci Technol. 2018;12(4):762–770. doi:10.1177/1932296818785612
- National Glycohemoglobin Standardization Program (NGSP). College of American Pathologists (CAP) Survey Data. Available from: https://ngsp.org/CAPdata.asp.
- National Glycohemoglobin Standardization Program (NGSP). HbA1c assay interferences. Available from: https://ngsp.org/interf.asp.
- Kushner PR, Fonseca V, Nichols JH, Shubrook JH, Miller E, Wright E, DeFilippi C, Vassalotti JA. Clinical need for point-of-care testing for diabetes in Clinical and Laboratory Improvement Amendments–waived settings. Clin Diabetes. 2024; doi:10.2337/cd24-0071.



