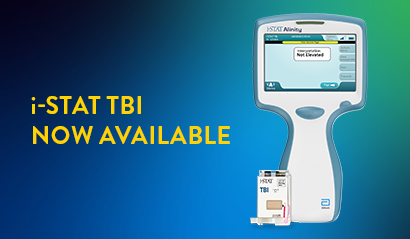
Global Point of Care
Point of Care Highlights
Featured Products
i-STAT 1 Wireless
Learn how the i-STAT 1 Wireless provides the ability to perform diagnostic tests and upload results to your EMR automatically from many patient-care areas.
Piccolo Xpress
The only portable diagnostic analyzer to offer a full complement of CLIA-waived blood chemistry tests at the point of care.
Afinion 2
The Afinion™ 2 analyzer is a compact, rapid, multi-assay analyzer that provides valuable near patient testing at the point-of-care. With the Afinion™ System, there’s no need to send test results to the lab or spend time tracking them down.
CHOLESTECH LDX™ ANALYZER
The Cholestech LDX™ Analyzer empowers healthcare professionals and patients with a lab-accurate complete lipid profile and glucose in 5 minutes per test cassette.
Service. Support. Answers.
Get all the detailed technical support and service you need – the way you need it. We’re here for you online and over the phone.


Service. Support. Answers.
Get all the detailed technical support and service you need – the way you need it. We’re here for you online and over the phone.